
nom féminin
(lat. mod. molecula, dimin. de moles, masse)
Groupement d'atomes qui représente, pour un corps pur qui en est constitué, la plus petite quantité de matière pouvant exister à l'état libre.
La matière, dans sa diversité, est formée de molécules construites à partir d'une centaine d'atomes différents, les éléments chimiques. L'existence des molécules a longtemps été contestée et la première preuve expérimentale (indirecte) n'a guère plus d'un siècle. En 1867, John Tyndall montre que la couleur bleue de l'eau des lacs profonds ne pouvait être due qu'à la diffusion de la lumière par de très petites particules, en l'occurrence les molécules d'eau.
Propriétés.
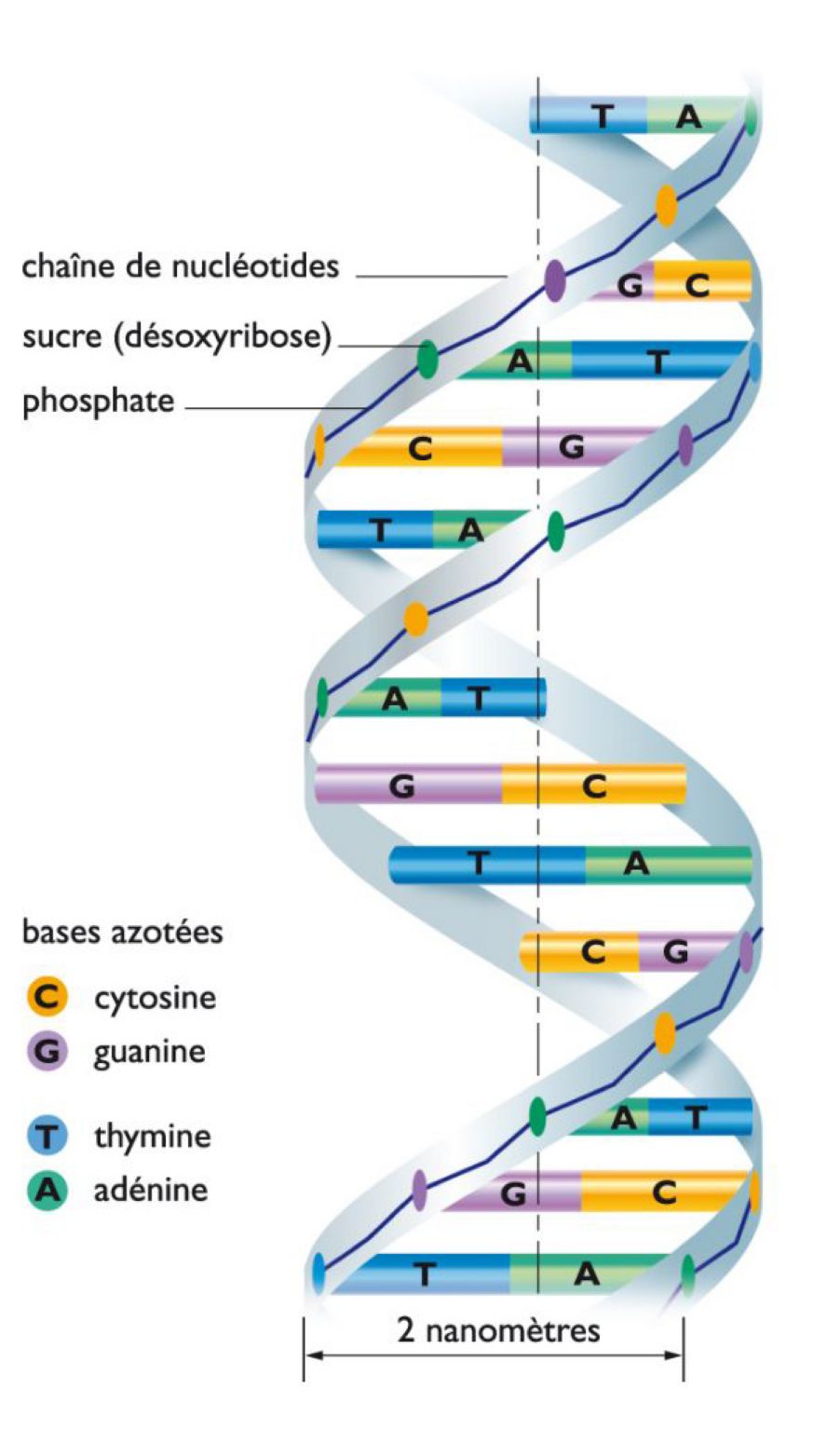
Les molécules ont des degrés de complexité allant des petites molécules d'oxygène ou d'azote aux longues hélices de l'ADN présent au cœur des cellules vivantes. L'arrangement spatial des atomes et la nature de leurs liaisons chimiques induisent des propriétés variées.
La forme d'une molécule suffit parfois à en expliquer les propriétés : c'est, par exemple, le cas des molécules de substance odorante qui s'insèrent dans un site du récepteur sensoriel ayant la même forme extérieure. Une différence de quelques atomes entre deux molécules suffit, par ailleurs, à changer du tout au tout leurs propriétés : ainsi de l'œstradiol C18H24O2 et de la testostérone C19H28O2, hormones sexuelles respectivement femelle et mâle.
La mole.
Pour travailler commodément sur des entités dont les plus petites ne dépassent pas quelques dix-millionièmes de millimètre, les chimistes ont introduit une unité de quantité de matière, la mole. La masse (en grammes) d'une mole d'un élément donné est égale au nombre de « nucléons » (protons et neutrons) contenus dans le noyau de l'atome de l'élément considéré. Le noyau du carbone, par exemple, contient 12 nucléons ; la masse de 6 . 1023 atomes de carbone est de 12 g. La mole permet donc d'établir un lien entre les caractéristiques microscopiques des molécules et des quantités qui nous sont perceptibles.