
nom masculin
(lat. carbo, -onis, charbon)
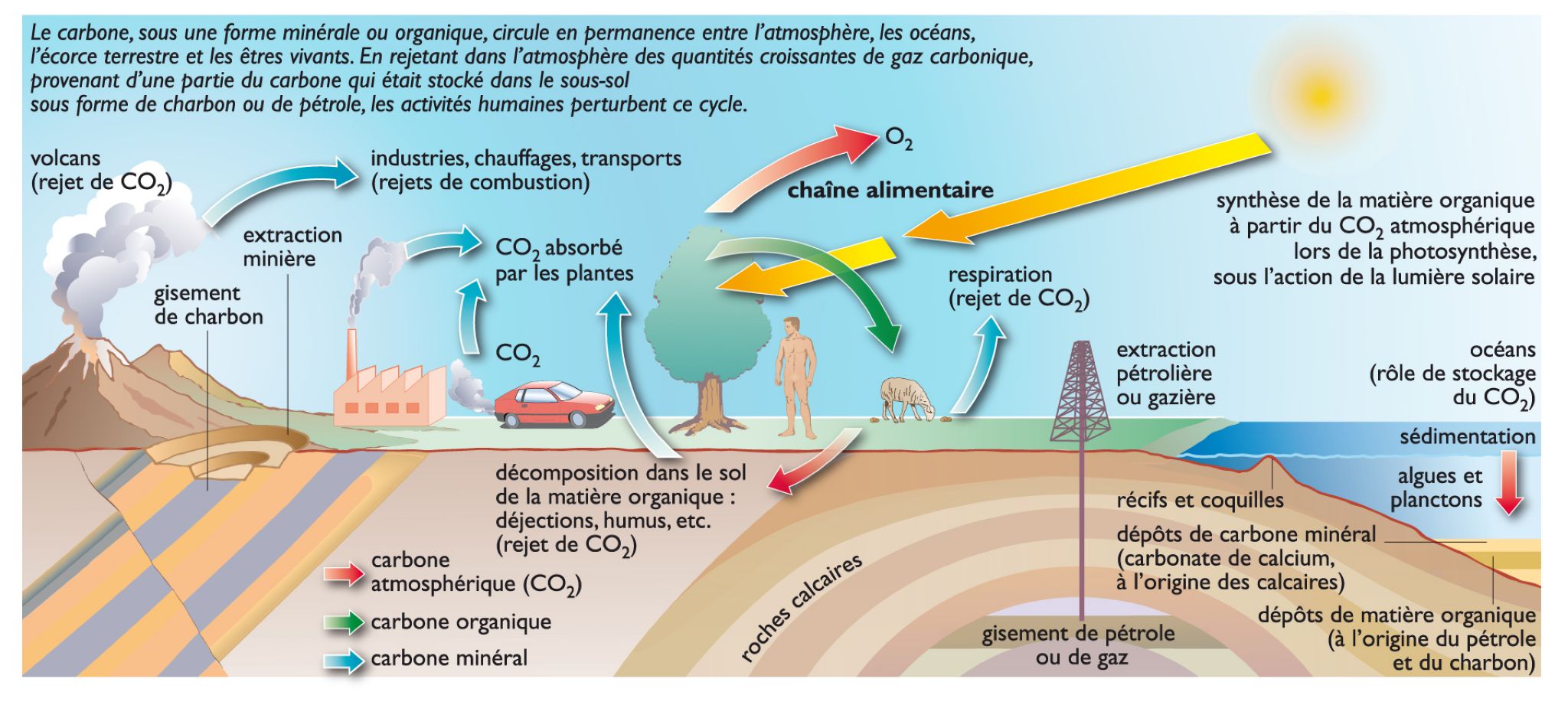
Dioxyde de carbone, gaz formé de deux atomes d'oxygène et d'un atome de carbone, produit par la combustion des liquides, la respiration des animaux et des plantes (SYN. gaz carbonique).► Formule : CO2.
Oxyde de carbone, gaz très toxique produit lors d'une combustion incomplète.► Formule : CO.
Papier carbone, papier enduit d'une couche pigmentée que l'on peut transférer par pression, utilisé pour obtenir des copies d'un document (on dit aussi un, du carbone).
Le carbone réagit avec de nombreux éléments, et beaucoup de ces combinaisons entrent dans la constitution des organismes vivants. L'étude de ces composés, naturels ou de synthèse, forme un domaine important de la chimie appelé chimie organique. Le carbone se combine aussi à de nombreux métaux, d'où son importance dans les processus métallurgiques.
Les propriétés physiques.
Parmi les différentes variétés de carbone, seules sont bien définies celles qui sont cristallisées (diamant et graphite) et constituent du carbone quasi pur. Dans le diamant, les atomes de carbone, disposés selon des tétraèdres, sont équidistants les uns des autres, ce qui confère une grande dureté au cristal. Dans le graphite, les atomes sont disposés en couches, où ils forment un réseau hexagonal régulier. Le carbone amorphe se trouve dans les charbons naturels et artificiels. (→ charbon.)
Les propriétés chimiques.
Le carbone a généralement la valence 4. Pour représenter les formules des composés organiques saturés, on admet que l'atome de carbone est au centre d'un tétraèdre régulier dont les sommets sont occupés par 4 atomes ou 4 radicaux univalents.
L'hydrogène réagit sur le carbone en donnant des hydrocarbures. L'oxygène, lors de la combustion, donne, selon les cas, du dioxyde de carbone (CO2) ou du monoxyde de carbone (CO). Le soufre réagit en formant du sulfure de carbone, employé comme solvant et dans la fabrication de la viscose. L'azote donne naissance à un cyanure. Le silicium et le bore donnent des carbures très durs SiC (abrasif) et B6C. Enfin, le carbone se combine à un grand nombre de métaux : le carbure de fer Fe3C est un constituant des fontes.
Les utilisations.
Du carbone : charbon activé (propriétés absorbantes), fibres (matériaux composites), métallurgie (réduction des oxydes métalliques), carbochimie (via la cokéfaction de la houille). Du diamant : joaillerie, outils de coupe (usinage des métaux, forage des roches, etc.). Du graphite : charbons des lampes à arc, électrodes, balais de dynamos (propriétés conductrices), lubrifiants (résistance à la chaleur), mines de crayons, pigments de peintures (propriétés colorantes), modérateur dans les réacteurs nucléaires (ralentisseur de neutrons).
Le carbone 14.
Produit dans l'atmosphère sous l'influence du rayonnement cosmique et rapidement oxydé en gaz carbonique, le carbone 14 pénètre dans les végétaux (par la photosynthèse) ou les animaux (suite au métabolisme), où son activité spécifique reste constante. Dès la mort de l'organisme, cette activité diminue par désintégration radioactive de période 5 730 ans, et sa mesure précise permet ainsi la datation d'échantillons d'origine organique.