
La matière
La matière est tout ce qui forme le monde, tout ce qui nous entoure. Sur la Terre, on peut dire que la matière est constituée par tout ce qui est pesant.
Il y a vingt-cinq siècles, le philosophe Leucippe puis son disciple Démocrite affirmèrent qu’elle était simplement constituée par une concentration de grains qu’ils appelèrent atomes.
Les atomes
▶ Description
Les atomes sont des particules très petites, de l’ordre de quelques dixièmes de nanomètre (1 nm = 10–9 m ; 1 nm est un milliardième de mètre). Ils sont composés d’un noyau, concentrant la presque totalité de leur matière, et d’électrons (charges électriques élémentaires négatives) qui gravitent autour de ce noyau.
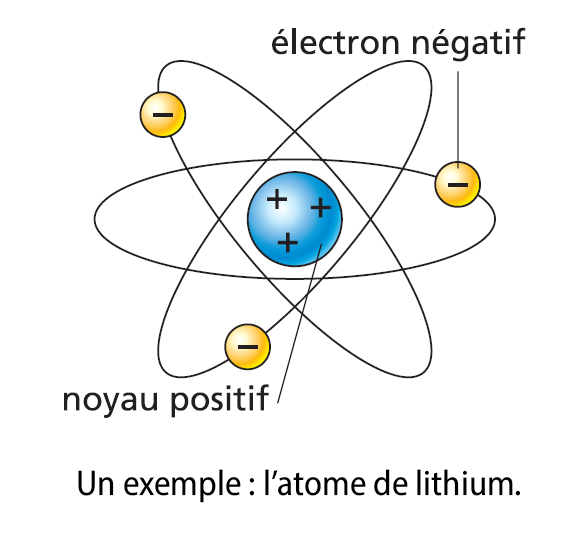
Chaque atome est neutre du point de vue électrique car le noyau porte autant de charges positives (les protons) qu’il existe d’électrons.
Dans la nature, il n’existe qu’une centaine de types d’atomes différents, classés selon le nombre d’électrons qu’ils possèdent. Ainsi, l’atome le plus simple, celui d’hydrogène, n’a qu’un seul électron, et l’un des plus lourds, l’atome d’uranium, en possède 92.
▶ Représentation
Chaque atome est représenté par un symbole : une lettre majuscule qui peut être suivie d’une deuxième lettre en écriture minuscule.
▶ Quelques exemples
|
Nom |
Symbole |
Nom |
Symbole |
|
Aluminium |
Al |
Hydrogène |
H |
|
Argent |
Ag |
Magnésium |
Mg |
|
Azote |
N |
Oxygène |
O |
|
Calcium |
Ca |
Sodium |
Na |
|
Carbone |
C |
Soufre |
S |
|
Cuivre |
Cu |
Uranium |
U |
|
Fer |
Fe |
Zinc |
Zn |
▶ Les molécules
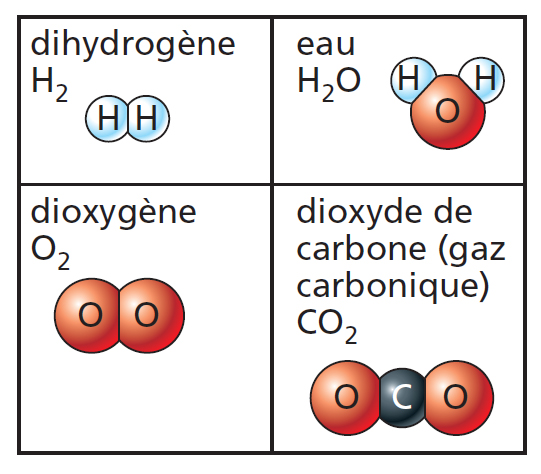
Les molécules sont des groupements d’atomes.
Leurs formules renseignent sur la nature et le nombre de leurs constituants.
▶ Les ions
Certains atomes peuvent, sous l’influence d’atomes voisins, perdre ou gagner des électrons. Ils deviennent alors, du point de vue électrique, des particules chargées : on les appelle des ions.
Les atomes qui perdent des électrons deviennent des ions positifs (les cations), qui sont donc chargés positivement.
Les atomes qui gagnent des électrons deviennent des ions négatifs (les anions), qui sont chargés négativement.
|
Cations |
Formules |
Anions |
Formules |
|
Calcium |
Ca2+ |
Hydrogéno-carbonate |
HCO−3 |
|
Magnésium |
Mg2+ |
Chlorure |
Cl− |
|
Potassium |
K+ |
Sulfate |
SO2−4 |
|
Sodium |
Na+ |
Nitrate |
NO−3 |