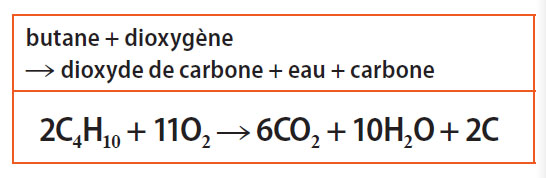La transformation chimique
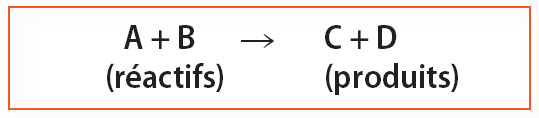
Une réaction chimique est une transformation au cours de laquelle des corps disparaissent (les réactifs) et où d’autres apparaissent (les produits).
Comprendre une transformation chimique
Au cours d’une réaction chimique, les molécules qui composent les réactifs se cassent et libèrent leurs atomes. Ceux-ci se regroupent autrement et forment d’autres molécules qui constituent les produits. Au cours d’une réaction chimique, les atomes se conservent. Ainsi, la masse totale des produits est la même que celle des réactifs.
Écrire une équation chimique
▶ L’équation-bilan
Une réaction chimique se traduit par une équation-bilan.
Pour écrire une équation chimique, il faut :
— indiquer, à gauche de la flèche, les formules du ou des réactifs et, à droite,
les formules du ou des produits formés ;
— équilibrer en plaçant des coefficients devant chaque formule afin que le nombre d’atomes de chaque espèce soit le même
à droite et à gauche de la flèche.
▶ Deux exemples
Exemple no 1 :
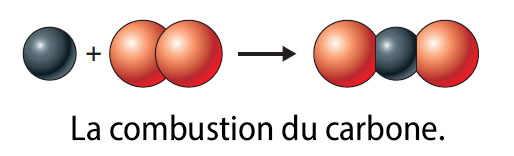
La combustion du carbone
Le charbon de bois, qui renferme en grande quantité du carbone, brûle dans le dioxygène pour donner du dioxyde de carbone :
carbone + dioxygène → dioxyde de carbone
En utilisant les formules des produits et des réactifs, le bilan se note :
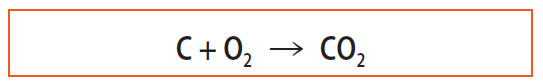
Remarque :
Le dioxyde de carbone est mis en évidence avec de l’eau de chaux, qu’il trouble.
Exemple no 2 :
La combustion du butane
Cette réaction dans l’air ou dans le dioxygène dégage de grandes quantités de chaleur : elle est dite « exothermique ».
Selon les conditions expérimentales, la réaction peut être complète ou incomplète.
Combustion complète : si le mélange butane-air est suffisamment riche en dioxygène, les produits formés par la combustion sont du dioxyde de carbone et de l’eau. La réaction est alors très exothermique (la flamme obtenue est bleue).
▶ L’équation-bilan :
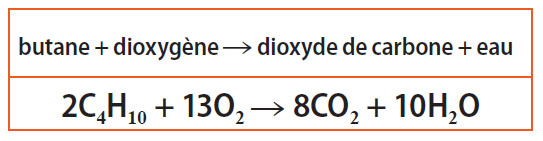
Combustion incomplète : si le mélange butane-air est pauvre en dioxygène, la combustion produit en outre du carbone qui colore la flamme en jaune ; la réaction est polluante.
▶ L’équation-bilan :