Les trois états de la matière
La matière se présente sous les états solide, liquide et gazeux. Solides, liquides et gaz font partie de notre environnement.
▶ L’état solide
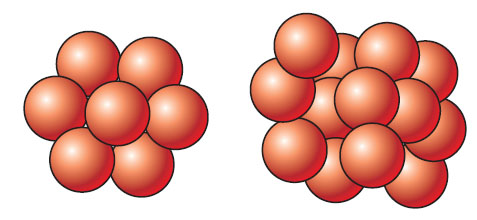
Un corps solide possède une forme propre. Son volume, à température constante, est invariable. Les solides sont généralement constitués par des empilements d’atomes liés les uns aux autres et disposés régulièrement ; ils forment souvent des cristaux.
▶ L’état liquide
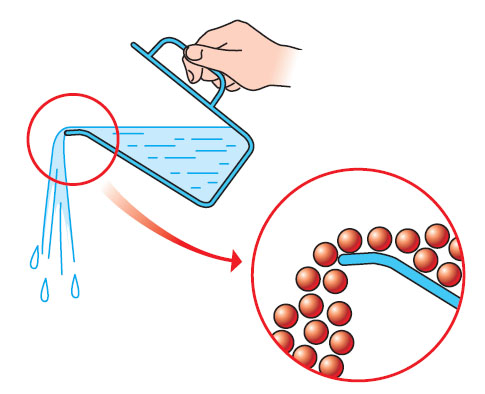
Un liquide ne possède pas de forme propre ; il prend la forme du récipient qui le contient. Son volume, comme celui d’un solide, ne varie pas si sa température ne change pas. Sa surface libre est plane et horizontale. Les particules qui le composent « glissent » librement les unes sur les autres.
▶ L’état gazeux
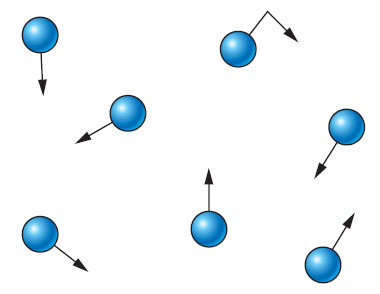
Un gaz occupe tout l’espace qu’on lui offre. Il se dilate ou se comprime facilement. Il est généralement composé de molécules très dispersées, animées de grandes vitesses.
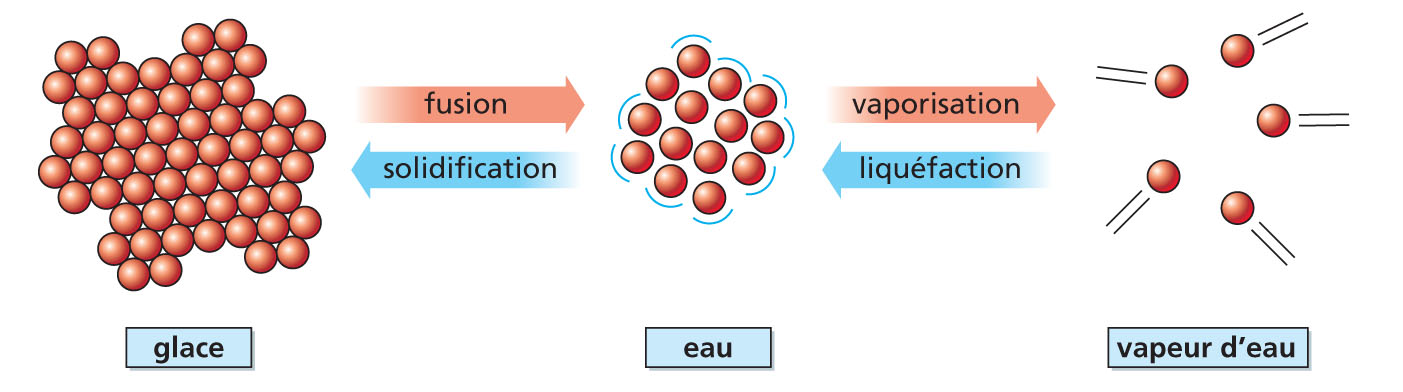
Les changements d’état
▶ Comment changer d’état ?
En chauffant ou en refroidissant une substance quelconque, il est possible de la faire passer d’un état à un autre.
Au cours de ces transformations, sa masse, contrairement à son volume, ne varie pas. Ces changements d’état mettent en jeu des transferts d’énergie.
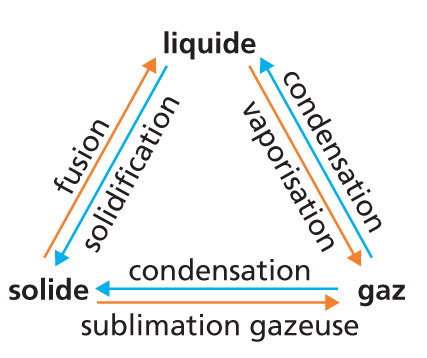
La température d’un changement d’état pour un corps pur est constante (à pression fixée). Elle est caractéristique de la substance.
▶ Comprendre les changements d’état de l’eau
Si l’on chauffe de la glace (c’est-à-dire de l’eau à l’état solide), on « casse » les liaisons qui existent entre les différentes molécules qui la constituent ; celles-ci peuvent alors « glisser » les unes sur les autres : on obtient de l’eau à l’état liquide.
En augmentant encore la température, on accroît l’agitation moléculaire, et certaines molécules peuvent alors quitter le liquide pour donner de la vapeur d’eau (eau à l’état gazeux).
Inversement, si l’on refroidit de la vapeur d’eau, les molécules qui la composent deviennent de moins en moins mobiles, restent en contact les unes avec les autres, et l’on obtient de l’eau à l’état liquide. Si l’on refroidit davantage, des liaisons se forment : on obtient de la glace.