
Les métaux
▶ Les métaux et les alliages
Les métaux sont des corps simples. Les plus usuels sont le fer, l’aluminium, le cuivre, le zinc et le plomb. Certains, comme l’or ou l’argent, sont plus rares et précieux. Les alliages, comme les aciers (fer et carbone), le bronze (cuivre et étain), le laiton (cuivre et zinc), sont des mélanges comprenant au moins un métal.

Les métaux possèdent tous certaines propriétés mécaniques comme la dureté, la plasticité et l’élasticité. Ils sont tous plus ou moins bons conducteurs de la chaleur et du courant électrique (les électrons peuvent se déplacer dans les métaux).
En versant de la soude dans des solutions contenant des ions métalliques, on caractérise les ions cuivre Cu2+ (précipité bleu), les ions fer (II) Fe2+ (précipité vert) et les ions fer (III) Fe3+ (précipité marron).
▶ Le fer
Le fer se trouve dans la nature sous forme de minerais. L’extraction du fer de ses minerais se fait dans les hauts-fourneaux. On obtient un alliage composé de fer, de carbone et d’impuretés : la fonte. Celle-ci est ensuite transformée en acier, en brûlant une partie du carbone et en éliminant les impuretés.
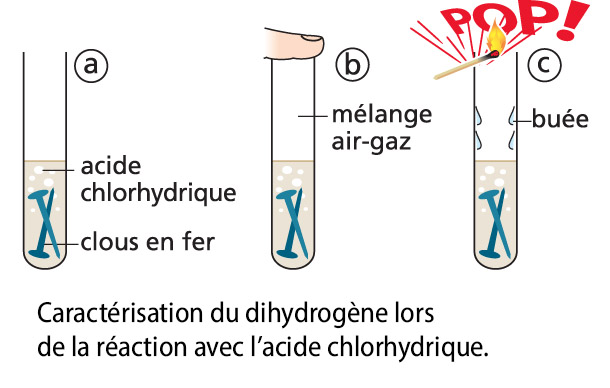
Le fer réagit avec l’acide chlorhydrique. La réaction produit du dihydrogène que l’on peut mettre en évidence par la légère explosion qu’il produit si on le fait brûler.
Équation-bilan :
|
fer + acide chlorhydrique → dihydrogène + chlorure de fer (II) |
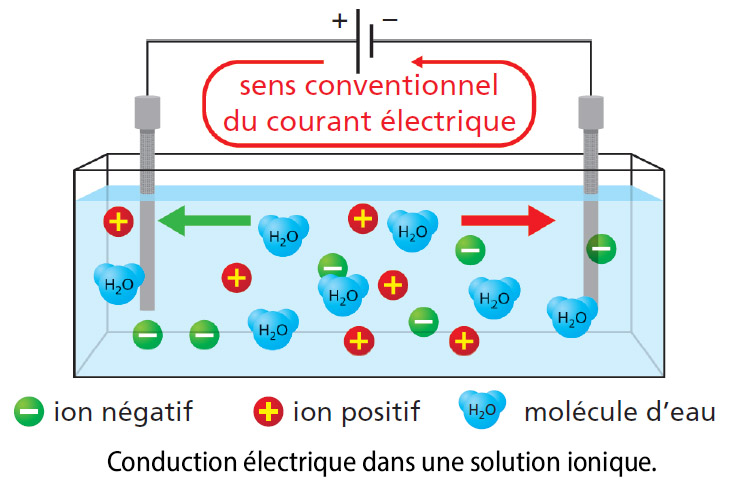
Conduction électrique dans les solutions aqueuses
Une eau salée peut conduire le courant électrique car elle contient des ions sodium positifs Na+ et des ions chlorure négatifs Cl- : c’est une solution ionique. Le courant électrique dans les solutions ioniques est dû à un déplacement des ions ; les ions positifs se déplacent dans le sens conventionnel du courant électrique et les ions négatifs se déplacent dans le sens inverse.
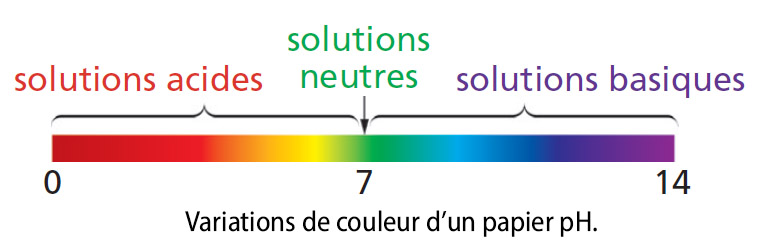
Le pH d’une solution
Le pH est un nombre qui permet de caractériser l’acidité ou la basicité d’une solution.
• Une solution aqueuse neutre (pH = 7) contient autant d’ions hydrogène H+ que d’ions hydroxyde HO-.
• Dans une solution acide (pH < 7), il y a plus d’ions hydrogène H+ que d’ions hydroxyde HO-.
• Dans une solution basique, il y a plus d’ions hydroxyde HO- que d’ions hydrogène H+.
Les produits acides ou basiques concentrés présentent un danger.
La synthèse d’espèces chimiques
Il est possible de réaliser la synthèse d’espèces chimiques déjà existantes dans la nature. Par exemple, l’arôme naturel de banane est principalement dû à l’acétate d’isoamyle qui peut être reproduit en laboratoire à l’aide d’une réaction chimique. Il est également possible de produire des espèces chimiques qui n’existent pas dans la nature. C’est le cas du Nylon, un textile composé de macromolécules (polyamide) comportant un grand nombre d’atomes. Il est synthétisé, comme les matières plastiques, à partir de dérivés du pétrole.